Fosfor adalah unsur
kimia yang memiliki lambang P dengan nomor atom 15. Fosfor berupa nonlogam, bervalensi banyak, termasuk golongan
nitrogen. Banyak ditemui dalam batuan fosfat anorganik dan dalam semua sel hidup tetapi tidak pernah ditemui dalam bentuk unsur bebas.
Fosfor terdapat dalam empat atau lebih bentuk alotropik: putih (atau kuning), merah, dan hitam (atau ungu). Fosfor biasa merupakan benda putih seperti lilin. Bentuknya yang murni tidak memiliki warna dan transparan. Fosfor putih memiliki dua modifikasi: alfa dan beta dengan suhu transisi pada -3,8 derajat Celcius.
Ia tidak terlarut dalam air, tetapi melarut dalam karbon disulfida. Ia dapat terbakar dengan mudah di udara dan membentuk pentaoksida.
Ia tidak terlarut dalam air, tetapi melarut dalam karbon disulfida. Ia dapat terbakar dengan mudah di udara dan membentuk pentaoksida.
Unsur fosfor dapat bereaksi dengan beberapa unsur lain membentuk senyawa-senyawa fosfor. Asam fosfat dapat berbentuk berupa asam hipofosfat, asam metafosfat, asam ortofosfat, asam polifosfat, maupun rantai panjang asam polifosfat. sedangkan asam fosfor dapat berupa asam hipofosfor, asam metafosfor, maupun asam ortofosfor. Sulfida fosfor dapat berupa P4S3 dan P4S10.
Senyawa Fosfonitril
Nitrogen (N) dan Fosfor (P) dapat berikatan bersama-sama, membentuk sejumlah besar phosphazanes. Dimana atom P dalam keadaan oksidasi (+V) dan N adalah (+III). Senyawa ini tak jenuh, sehingga monophosphazines dapat dibuat dengan mereaksikan azida dengan PCl3, POR3 atau P(C6H5)3.
Senyawa Fosfonitril
Nitrogen (N) dan Fosfor (P) dapat berikatan bersama-sama, membentuk sejumlah besar phosphazanes. Dimana atom P dalam keadaan oksidasi (+V) dan N adalah (+III). Senyawa ini tak jenuh, sehingga monophosphazines dapat dibuat dengan mereaksikan azida dengan PCl3, POR3 atau P(C6H5)3.
PCl3 + C6H5N3 ® Cl3P=NC6H5 + N2
P(C6H5)3 + C6H5N3 ® (C6H5)3P=NC6H5 + N2
Senyawa Siklofosfazen
Senyawa Organofosfat
Banyak senyawa organofosfat yang bersifat racun. Beberapa telah digunakan sebagai pestisida, herbisida dan gas . Sisanya bagian penting dalam kehidupan.
Asam Ortofosfat (H3PO4)
Pembentukan garam :
- Fosfat dihidrogen, yang sedikit asam dalam air. Contoh NaH2PO4
- Fosfat Monohidrogen, yang sedikit basa dalam air. Contoh Na2HPO4
- Fosfat Normal, yang cukup basa dalam larutan. Contoh Na3PO4
NaH2PO4 dan
Na2HPO4
dibuat diindustri dengan
menetralisir H3PO4 dengan abu soda
(Na2CO3), dan NaOH digunakan untuk membuat Na3PO4.
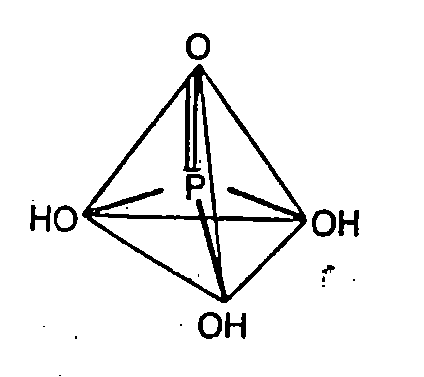
Struktur Asam Ortofosfor
Polifosfat
Asam polifosfat dan garamnya memiliki jumlah yang sangat besar
, muncul dengan polimerisasi asam [PO4] membentuk asam isopoly. polifosfat terdiri dari rantai
tetrahedra, masing-masing berbagi atom O pada satu atau dua sudut [PO4]
tetrahedron, memberikan rantai sederhana yang tidak bercabang, seperti pembentukan pyroxenes oleh silikat.
Polifosfat adalah senyawa rantai lurus. Kebasaan dari berbagai asam, yaitu dengan mengganti jumlah atom H yang dapat ditemukan melalui penggambaran struktur dan menghitung
jumlah kelompok OH.
Struktur Asam pirofosfat (H4P2O7)
Struktur Asam Tripolifosfat (H5P3O10)
Rantai Panjang Polifosfat - Metafosfat
Awalnya rantai polifosfat disebut metafosfat, karena memiliki rantai yang sangat panjang sehingga sulit dibedakan dengan metafosfat. Namun, nama metaphosphates adalah nama yang digunakan
untuk senyawa cincin, maka polifosfat disebut sebagai linier metafosfat.
Metafosfat - Siklofosfat
Metafosfat merupakan senyawa cincin. Nama lama metafosfat masih banyak digunakan meskipun menurut IUPAC penamaan siklo harus digunakan untuk menunjukkan bentuk cincin.
Di-metaphosphate ion (cyclo-diphosphate)
Tri-metaphosphate ion (cyclo-triphosphate)
Tertra-metaphosphate ion (cyclo-tetraphosphate)
Asam Metafosfor (HPO2)n
Dapat diperoleh dari fosfin (PH3) dalam tekanan rendah
PH3 + O2 --> H2 + HPO2
Jika bentuk molekulnya HPO2, maka atom P hanya menyediakan 3 ikatan atau terdapat ikatan rangkap
.
H3PO2 Berisi P dalam keadaan oksidasi (+1) dan memiliki satu
atom O yang lebih sedikit dari asam ortofosfit. Asam merupakan monobasa dan agen pereduksi yang kuat. Garam asam ini disebut
hipofosfit (hypophosphites) dan natrium hipofosfit NaH2PO2 yang digunakan dalam industri pemutihan kayu untuk pembuatan kertas.
P4S3
Fosfor trisulfida adalah sulfida yang paling stabil. Dibuat dengan memanaskan fosfor merah dan sulfur dengan jumlah terbatas pada suhu180 0C dalam atmosfer inert. Digunakan secara komersial untuk membuat pengisi lem .
P4S10 adalah sulfida paling penting. Ini dibuat dengan mereaksikan fosfor putih cair pada suhu 300oC dengan sedikit sulfur berlebih. Produksi di dunia sekitar 250000 ton/tahun. Jika dihidrolisis dalam air, maka akan membentuk asam fosfat.
Daftar Pustaka
J.D. Lee.
1991. Concise Inorganic
Chemistry 4th ed (e-book). London:
Champan & Hall
Mohsin, Yulianto.
2010. Fosfor. http://www.chem-is-try.org/tabel_periodik/fosfor/. Diakses
23 April 2014
Saito,
Taro. 2009. Asam Okso Fosfor,
Belerang Oksida dan Asam-asam Okso Belerang. http://www.chem-is-try.org/materi_kimia/kimia-anorganik-universitas/kimia-unsur-non-logam/asam-okso-fosfor-belerang-oksida-dan-asam-asam-okso-belerang/. Diakses
23 April 2014






makasih postingannya ^^ membantu skripsi saya :P kemaren nemu juga di kimia dasar jilid 3 juga tapi penjelasannya agak berbelit ..
BalasHapus